Existen miles de ejemplos de reacciones químicas, desde las más simples hasta las más complicadas. Una reacción química es un proceso donde los átomos de una o más sustancia se intercambian con otra y forman una nueva sustancia.
A continuación encontrarás ejemplos de reacciones químicas.
1. Reacción de descomposición del azúcar de mesa
El azúcar de mesa, la sacarosa, está formada por la glucosa y la fructosa. En la reacción de descomposición se rompe la unión entre la fructosa y la glucosa:
2. Reacción de formación de jabones

Los jabones que usamos para eliminar la suciedad se hacen desde la antiguedad haciendo reaccionar las grasas con el hidróxido de sodio. Esta reacción se llama saponificación.

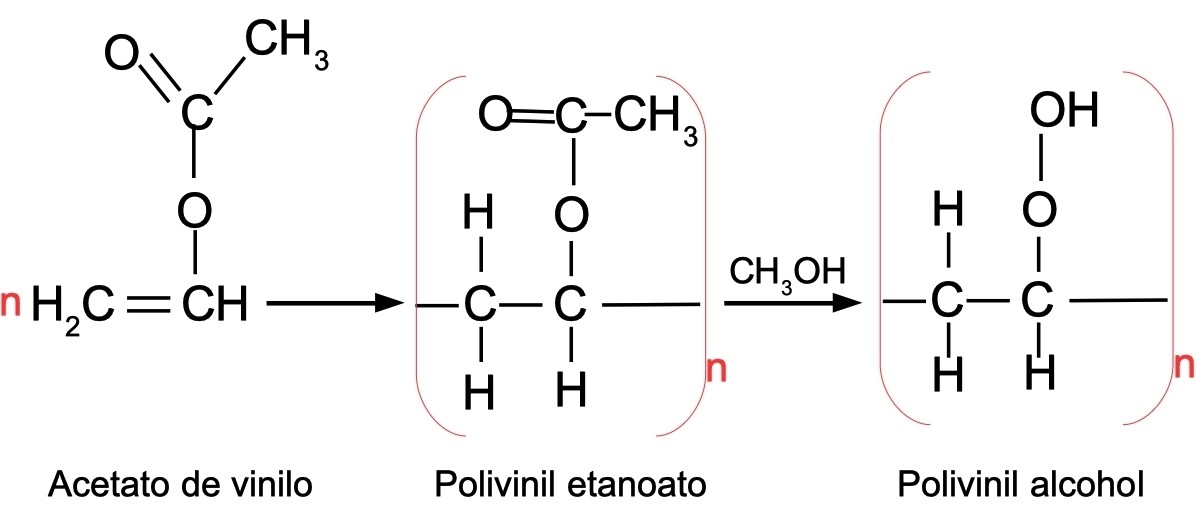
3. Reacción de formación de plástico biodegradable
El polivinil alcohol es un plástico biodegradable que se forma de la condensación de un gran número de moléculas de acetato de vinilo, que luego reacciona con metanol:
4. Reacción de neutralización de un ácido y una base
Cuando una base, como el hidróxido de sodio (NaOH), reacciona con un ácido, como el ácido clorhídrico (HCl), se produce una reacción de neutralización, donde los productos son una sal, el cloruro de sodio (NaCl), y agua, H2.
5. Reacción de combustión de la gasolina
La gasolina es una mezclas de compuestos formados por hidrógeno y carbono, llamados hidrocarburos. En la reacción de combustión de cualquier hidrocarburo, este reacciona con el oxígeno para producir dióxido de carbono CO2 y agua:
6. Reacción de desgaste de la cal por la lluvia ácida
La lluvia ácida trae consigo ácido sulfúrico. El ácido sulfúrico reacciona con el carbonato de calcio (cal) formando sulfato de calcio, dióxido de carbono y agua:
El sulfato de calcio se disuelve con mayor facilidad con el agua. Esta reacción es la causante del desgaste de los edificios y esculturas por el efecto de la lluvia ácida.
7. Reacción exotérmica de combustión del propano
La reacción de combustión se produce cuando un compuesto con carbono (compuesto orgánico) reacciona con el oxígeno O2. La combustión del propano C3H8 es una rección exotérmica porque se libera calor.
8. Reacción de la comida tostada

El sabor de la carne frita, el café tostado, la concha del pan horneado y las cebollas caramelizadas se deben a una reacción entre los aminoácidos y los azúcares de los alimentos. Esta reacción lleva el nombre de reacción de Maillard:
9. Reacción de sustitución simple del cobre y el nitrato de plata
Una reacción de sustitución simple se produce cuando un elemento o ión se coloca en el lugar de otro en un compuesto.
Cuando reacciona el cobre (Cu) en una solución acuosa de nitrato de plata (AgNO3), el cobre desplaza a la plata y forma nitrato de cobre (Cu(NO3)2) y se precipita la plata Ag:
10. Reacción de doble desplazamiento del etanoato de mercurio y yoduro de sodio
Una reacción de doble desplazamiento se produce cuando hay intercambio de dos partes de un compuesto con las dos partes de otro compuesto.
El etanoato de mercurio cuando reacciona con el yoduro de sodio (NaI), el yodo (I) se combina con el mercurio (Hg) formando ahora el yoduro de mercurio (HgI2). Al mismo tiempo, el sodio se combina con el etanoato formando etanoato de sodio:
11. Reacción para analizar el hierro en las aguas
Para analizar el contenido de hierro de los pozos de agua, el hierro se oxida a ion férrico y luego este reacciona con iones hidroxilo, para producir el hidróxido de hierro, Este compuesto es sólido y precipita:
12. Reacción de descomposición del hidróxido de hierro
El hidróxido de hierro cuando se le somete a una fuente de calor se descompone en óxido férrico y agua que se evapora:
13. Reacción ácido-base de soda cáustica y ácido sulfúrico
Una reacción ácido-base se produce cuando un ácido, como el ácido sulfúrico, y una base, como el hidróxido de potasio, se ponen en contacto. El resultado es una sal, el sulfato de potasio y agua:
14. Reacción de producción de ácido sulfúrico
En la industria de los fertilizantes se necesita el ácido sulfúrico. Este se obtiene a partir de la reacción de óxido-reducción del sulfuro de hierro FeS2.
Cuando el sulfuro de hierro es expuesto al oxígeno y al agua, se produce una reacción de óxido-reducción que da como resultado hidróxido de hierro y ácido sulfúrico:
15. Reacción de precipitación de nitrato de bario y sulfato de sodio
Cuando reaccionan el nitrato de bario y el sulfato de sodio que son soluble en agua, se forma nitrato de sodio (soluble en agua) y sulfato de bario que no se disuelve en agua, y, por lo tanto, se precipita.
Esta reacción es también del tipo de doble desplazamiento.
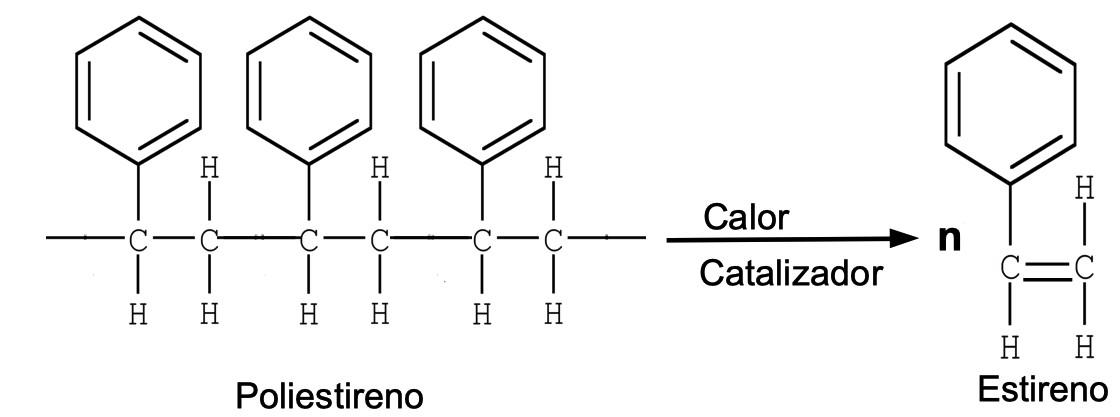
16. Reacción de reciclaje del anime
El poliestireno es un polímero plástico, empleado en los embalajes y vasos de anime. Para reciclarlo se puede hacer reaccionar con catalizadores y altas temperaturas, lo que hace que se liberen los monómeros de estireno:
17. Reacción de descomposición del agua por electricidad
Cuando se hace pasar una corriente eléctrica por el agua, esta se descompone en hidrógeno y oxígeno:
Esta reacción también se conoce como electrólisis del agua.
18. Reacción de formación del sabor a piña
En la industria alimenticia se usan sustancias que le dan sabor a los alimentos. Por ejemplo, en las gelatinas de piña no se usa la fruta como tal, sino compuestos que simulan el olor y sabor de la piña como el hexanoato o caproato de metilo.
El ácido hexanoico (o ácido cáprico) es un ácido orgánico que cuando reacciona con el metanol (CH3OH), se esterifica a hexanoato de metilo:
La reacción de esterificación es la reacción entre un ácido y un alcohol para formar un éster.
19. Reacción exotérmica de sodio y el agua
El sodio es un metal alcalino que cuando reacciona con el agua se forma hidróxido de sodio, hidrógeno y calor:
20. Reacción reversible entre dióxido de nitrógeno y oxígeno
Una reacción es reversible cuando los productos pasan a ser reactantes, y los reactantes son productos. En este caso, la reacción se representa con flechas bidireccionales.
El dióxido de nitrógeno NO2 se descompone en oxígeno y monóxido de nitrógeno NO. Luego el oxígeno y el monóxido de nitrógeno se combinan para formar el dióxido de nitrógeno:
21. Reacción de síntesis del cloruro de amonio
El ácido clorhídrico y el amoníaco se combinan para sintetizar el cloruro de amonio:
22. Reacción endotérmica de hidróxido de bario y cloruro de amonio
Cuando reaccionan el hidróxido de bario (Ba(OH)2) y el cloruro de amonio (NH4Cl), se forma cloruro de bario (BaCl2), amoníaco (NH3) y agua:
Esta reacción es endotérmica, pues absorbe energía del medio.
Vea también:
- Reacciones químicas
- Tipos de reacciones químicas
- Reacciones de óxido-reducción
- 18 ejemplos de ecuaciones químicas balanceadas y su significado
Referencias
Commons, C., Commons, P (coordinadores) (2020). Heinemann Chemistry 1, 5th ed. Pearson Australia. Melbourne.