El átomo es la partícula más pequeña característica de un elemento. Un modelo atómico es una representación visual de cómo debe ser y estar formado un átomo.
La dificultad para observar el átomo estimuló a muchos científicos a proponer modelos atómicos para ayudar a entender y estudiar su estructura y comportamiento. Estos modelos han ido evolucionando con el tiempo: apenas recientemente es que tenemos la tecnología disponible para visualizarlo.
Modelo atómico de Demócrito
La idea original de la existencia de los átomos surgió en la Antigua Grecia en el siglo V a. de C. gracias a Demócrito (470-380 a.C.) y a su maestro Leucipo.
En realidad, Demócrito planteó el concepto de átomo, como la partícula más pequeña que formaba los materiales. La palabra átomo en griego significa "indivisible". Esta sería la primera teoría atómica de la que se tiene registro. Sin embargo, no había forma de demostrar si era correcto y fue una simple especulación filosófica.
El primer modelo del átomo apareció apenas en el siglo XIX.
Modelo atómico de Dalton

Estudiando las leyes de los gases, el meteorólogo inglés John Dalton (1766-1844) propuso la primera teoría atómica. Según él, el átomo era la parte más pequeña de la materia, la que ya no podía seguir dividiéndose.
La forma de representar el átomo era como una esfera sólida, parecida a una bola de billar. De hecho, Dalton y los que apoyaron su teoría, tallaron bolas en madera de diferentes tamaños, simulando átomos de diferentes elementos.
Para la época, se desconocía por completo la existencia del electrón y del protón, por lo que el modelo de Dalton persistió por casi un siglo.
Vea también Modelo atómico de Dalton.
Modelo atómico de Thomson

En 1897, el físico inglés Joseph John Thomson (1865-1940), trabajando con tubos al vacío, fue capaz de mostrar la deflexión de los rayos catódicos en un campo eléctrico. Para aquella época, se aceptó que los rayos catódicos eran corrientes de partículas cargadas negativamente.
En 1891, el físico irlandés George Johnstone Stoney (1826-1911) sugirió el nombre de electrón para la sustancia que producía la electricidad. En su honor, Thomson llamó electrón a las partículas que descubrió.
Las ideas de Thomson se resumen a continuación:
- Los protones y electrones son partículas con cargas iguales pero de signo opuesto.
- En un átomo neutro la carga es cero, ya que la cantidad de electrones negativos es igual a la cantidad de protones positivos.
- Un átomo tiene la forma de una esfera con un radio de 0,00000001 cm, donde protones y electrones están distribuidos al azar.
- La masa de los electrones no se toma en cuenta debido a su insignificancia, por lo que la masa del átomo es igual a la masa de los protones.
Fue así como Thomson propuso que el átomo era una esfera sólida de material cargado positivamente con electrones negativos clavados, como uvas pasas en una torta o pudín.
Sin embargo, la idea de un átomo sólido cargado positivamente no se mantuvo. Tampoco este modelo presenta neutrones.
Modelo atómico de Perrin

El físico francés Jean Perrin (1870-1942) publicó en 1901 lo que sería el primer modelo basado en el sistema planetario. La radiactividad podía explicarse como la disminución de la atracción eléctrica del sol atómico por los electrones más externos (los Neptunos del sistema, como los llamaba Perrin).
Sin embargo, este modelo no pasó de ser un simple bosquejo, y Perrin no mostró interés en continuar su estudio. De hecho, Perrin ganó el premio Nobel de Física en 1926 por sus trabajos en el movimiento de partículas en fluidos.
Curiosamente, en 1924 Perrin fue jurado de la tesis de Louis de Broglie, donde mostraba las propiedades de onda de los electrones.
Modelo atómico de Nagaoka

El físico japonés Hantaro Nagaoka (1865-1950) propuso en 1903 un modelo atómico con electrones orbitando en círculos alrededor de una gran masa central positiva. Sus investigaciones fueron publicadas en inglés en 1904.
Según Nagaoka, el sistema de partículas era similar al sistema de Saturno. Este consistía en:
- Un gran número de partículas de igual masa dispuestas en círculos que se repelen entre sí;
- Una masa central cargada positivamente que atrae a las otras partículas cargadas negativamente, con la consecuente formación de anillos.
Esta configuración podía explicar los fenómenos de radiactividad recientemente descubiertos, y los espectros de emisión de luz de los elementos.
Modelo atómico de Rutherford

Le correspondió a un brillante estudiante de J.J. Thomson, el físico neozelandés Ernest Rutherford (1871-1937), resolver el problema de la estructura del átomo en 1911, en Inglaterra.
Aprovechándose del descubrimiento de la radiactividad en 1896, Rutherford y sus estudiantes, Hans Geiger y Ernest Marsden, usaron partículas radiactivas alfa de gran velocidad y energía, bombardearon elementos químicos y calcularon el ángulo de desviación (dispersión) de las partículas.
Si el átomo era como el modelo propuesto por Thomson, las partículas alfa atravesarían el elemento y la desviación sería mínima. En cambio, observaron que algunas partículas rebotaban. Esto solamente podría explicarse si el átomo tuviera un núcleo muy pequeño y condensado.
De estos resultados, Rutherford extrajo los siguientes postulados:
- Existe una pequeña región densa cargada positivamente, llamada núcleo.
- La masa del átomo es aproximadamente igual a la masa de los protones y electrones.
- Los protones dentro del núcleo están concentrados en el centro del átomo, y los electrones distribuidos al azar alrededor de estos.
Rutherford sugirió entonces que el átomo era como el sistema solar, donde el núcleo era el Sol y los electrones eran los planetas que orbitaban a su alrededor.
Ver también Modelo atómico de Rutherford.
Modelo atómico de Bohr
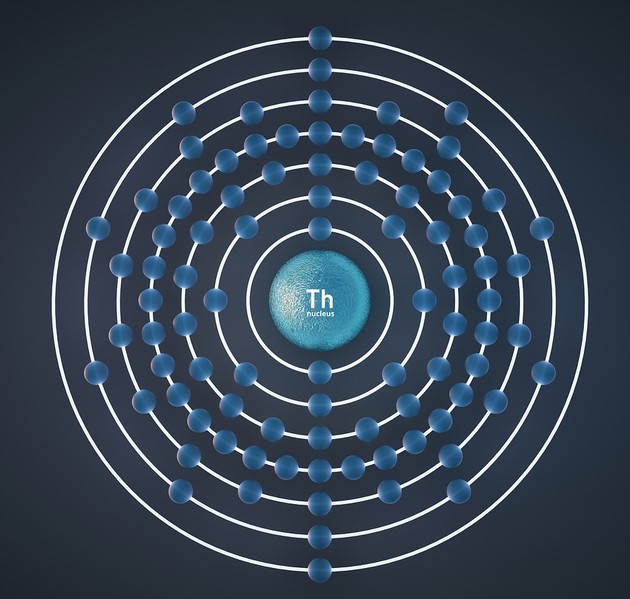
El modelo planetario del átomo tenía problemas: si los electrones orbitaban libremente alrededor del núcleo, perderían energía y colapsarían en algún momento dentro del núcleo.
Niels Bohr (1885-1962) fue a la Universidad de Manchester en Inglaterra a estudiar con Rutherford. Este joven físico danés inventó en 1913 el modelo atómico que destronaría al modelo propuesto pocos años antes por su profesor.
Bohr se valió de las ideas de Max Planck y Albert Einstein y postuló que los electrones podían tener una cierta cantidad de energía. Arregló los electrones en órbitas circulares con una cantidad específica de energía. También explicó que si un electrón salta de un orbital de alta energía a uno de menor, esto produciría un fotón, con lo cual quedaba resuelto también el fenómeno de los espectros de absorción de los elementos.
Los postulados de Niels Bohr se resumen de la siguiente forma:
- Los electrones en un átomo se mueven de forma estable a una cierta distancia del núcleo con una energía definida. Esto es lo que se llama el estado estacionario.
- Los electrones en cada estado estacionario siguen una ruta u órbita circular. Cada órbita recibe el nombre de "nivel energético" o "capa".
- Cuando el electrón está en el estado estacionario, no produce luz (fotón). Sin embargo, cuando baja de nivel energético, emite un fotón.
- Los niveles estacionarios, o capas, se denominan con las letras K, L, M, N, y así sucesivamente.
Los postulados de Bohr llevaron a representar el átomo como las capas o anillos de una cebolla. Sin embargo, el modelo de Bohr no sirvió para explicar átomos con más de un electrón.
Vea también Modelo atómico de Bohr
Modelo mecánico cuántico del atómo

El modelo mecánico cuántico del átomo es el modelo aceptado en la actualidad. Los tres físicos que contribuyeron al conocimiento del átomo moderno fueron Werner Heisenberg (1901-1976), Louis de Broglie (1892-1987) y Erwin Schrödinger (1887-1961).
En este caso, el electrón se comporta como una onda estacionaria y ya no se habla de órbitas sino de nubes electrónicas. Las nubes electrónicas son espacios alrededor del núcleo donde probablemente se pueda encontrar el electrón.
Aquí cada electrón tiene una dirección específica reflejada en los números cuánticos, que son cuatro:
- Número cuántico principal: el nivel energético n = 1 (K), 2 (L), 3 (M), 4 (N)...
- Número cuántico secundario: la subcapa l = s, p, d, f.
- Número cuántico magnético: el orbital m = x, y, z.
- Número cuántico spin: el tipo de spin del electrón s = +1/2, -1/2.
En este sentido, no hay dos electrones que tengan los mismos números cuánticos. Esto se conoce como el principio de exclusión de Pauli, gracias al físico austríaco Wolfgang Pauli (1900-1958).
¿Qué hay de nuevo en el átomo?

En 1932, James Chadwick (1891-1974) descubrió el neutrón, una partícula subatómica elusiva y difícil de detectar. El neutrón se encuentra en el núcleo de todos los átomos, excepto en el de hidrógeno. No tiene carga y su masa es un poco mayor que la del protón.
En 1970, Albert Victor Crewe (1927-2009) fotografió los átomos de uranio y torio usando un microscopio electrónico de transmisión de barrido.
Hoy en día se conoce que el átomo no solamente está compuesto de electrones, protones y neutrones. Estos a su vez están formados por partículas elementales conocidos como bosones y fermiones.
El modelo estándar es un modelo matemático que agrupa las partículas elementales y explica las fuerzas que las gobiernan. El gran colisionador de hadrones es la tecnología que emplean los físicos en la actualidad para estudiar estas partículas.
Vea también: Átomo e Historia de la química.
Prueba tus conocimientos con ejercicios sobre átomos.
Referencias
Hart-Davis, A. (editor jefe) (2009) Science, the definitive visual guide. DK Publishing. NY.
Pullman, B, (1998) The atom in the history of human thought. Oxford University press. Oxford.
Yagi, E. (1972) The development of Nagaoka's Saturnian Atomic Model II (1904-05). Japanese Studies in the History of Science 11:73-89