Las reacciones de oxidación-reducción, también llamadas óxido-reducción o redox, son aquellas donde las sustancias que reaccionan transfieren electrones entre sí. Es decir, una sustancia le pasa parte de sus electrones a otra sustancia, formando productos nuevos.
Ejemplos de reacciones de óxido-reducción están presentes en la corrosión del hierro, en la combustión de la gasolina y en la batería de los coches.
En la reacción entre el hierro Fe y el oxígeno O2 para formar óxido de hierro(III) Fe2O3, el hierro le transfiere electrones (e-) al oxígeno:
Esta transferencia de electrones se lleva a cabo en dos medias reacciones:
- Reacción de oxidación: transformación química donde una especie química pierde electrones. Por ejemplo, en la oxidación de hierro, este pierde 3 electrones:
- Reacción de reducción: transformación química donde una especie química acepta electrones. Por ejemplo, en la reducción del oxígeno, este gana dos electrones:
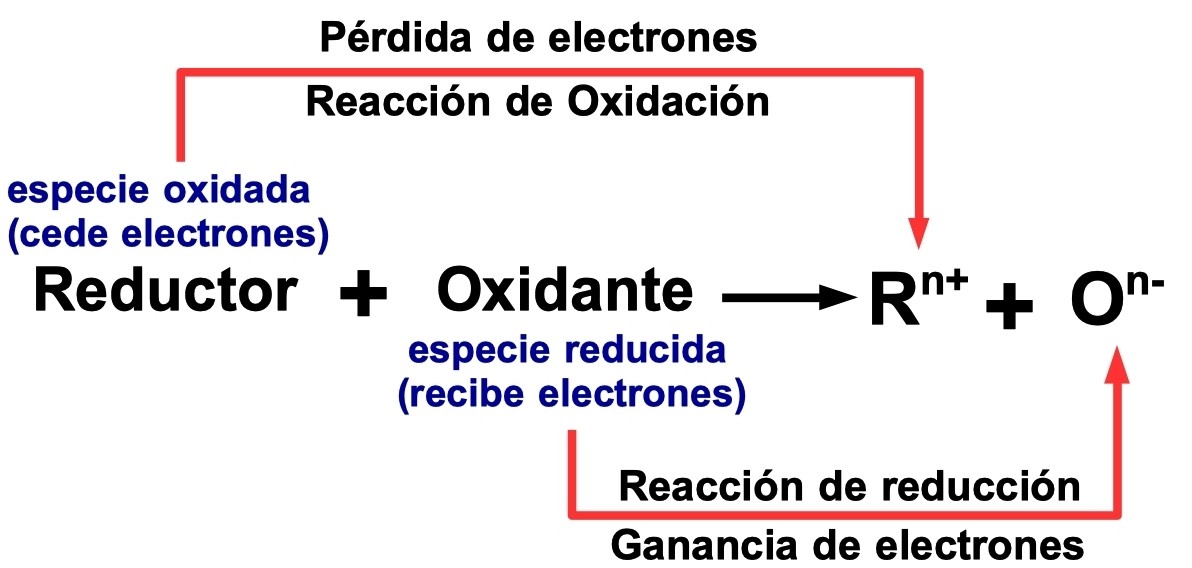
En las reacciones de oxidación-reducción hay dos especies químicas:
- Especie oxidada: que experimenta oxidación, es decir, cede electrones. La especie oxidada funciona también como agente reductor.
- Especie reducida: que experimenta reducción, es decir, recibe electrones. La especie reducida es al mismo tiempo el agente oxidante.
En la reacción entre el zinc (Zn) y el ion cobre (Cu2+), el Zn es el reductor (especie oxidada) que aporta los electrones y el Cu2+ es el oxidante (especie reducida) que recibe los electrones.
Número de oxidación y cómo se calcula
El número de oxidación es el número que se le asigna a cada átomo en una especie química. De esta forma se sigue el paso de electrones entre las mismas. El número de oxidación también se conoce como estado de oxidación.
Existen unas reglas básicas para asignar el número de oxidación:
1. En elementos libres el número de oxidación es 0 (cero), ejemplo: el oxígeno gaseoso O2, el hidrógeno gaseoso H2, el sodio metálico Na, el hierro metálico Fe.
2. En los compuestos binarios iónicos, el número de oxidación es la carga por átomo. Por ejemplo, el cloruro de cadmio CdCl2 es un compuesto iónico. El número de oxidación del cadmio es +2 (Cd+2) y el del cloro es -1 (Cl-1.
3. El flúor cuando forma fluoruros tiene un número de oxidaxión de -1, como en el fluoruro de hidrógeno.
4. El número de oxidación del oxígeno en compuestos covalentes es -2. Ejemplo, en el agua H2O y el dióxido de carbono CO2.
5. El número de oxidación del oxígeno cuando forma peróxidos es -1. Ejemplo peróxido de hidrógeno H2O2, el peróxido de magnesio MgO2 y el peróxido de sodio Na2O2.
6. El número de oxidación del hidrógeno en los compuestos es +1. Por ejemplo, en el amoníaco NH3, el nitrógeno tiene el número de oxidación -3, mientras el hidrógeno tiene el número de oxidación +1. Al tener 3 átomos de hidrógeno unidos al nitrógeno, la molécula de amoníaco queda con carga neutra
7. El número de oxidación del hidrógeno en los hidruros metálicos es -1, como el hidruro de calcio CaH2, el hidruro de sodio NaH.
Las reglas de asignación de número de oxidación están resumidas en esta tabla:
| Átomo | Número de oxidación | Ejemplos |
|---|---|---|
| Un átomo en un elemento | 0 | Sodio metal Na(s) Oxígeno (gas) O2(g) Ozono O3 Mercurio Hg(l) |
| Ión monoatómico | Igual a su carga | Na+ =+1 Cl-=-1 Ca+2= +2 |
| Fluoruro | -1 | Fluoruro de hidrógeno HF Trifluoruro de fósforo PF3 |
| Oxígeno en compuestos covalentes (excepto peróxidos) |
-2 |
Agua H2O |
| Oxígeno en peróxidos | -1 | Peróxido de hidrógeno H2O2 |
| Hidrógeno en compuestos covalentes | +1 | Agua H2O ácido clorhídrico HCl Amoníaco NH3 |
| Hidrógeno en hidruros metálicos | -1 |
hidruro de calcio CaH2 |
Ejemplos de reacciones de oxidación-reducción
Formación de fluoruro de sodio
El fluoruro de sodio NaF es un compuesto iónico que se utiliza para añadir flúor en el agua. Se forma por la reacción del sodio Na y el flúor F2:
En esta reacción, el sodio sólido, con número de oxidación 0, reacciona con moléculas de flúor diatómicas con número de oxidación 0, para formar el sólido iónico NaF, que contienen iones Na+ y F-. En este caso, el Na es el agente reductor o la especie oxidada porque aporta su electrón y el F2 es el agente oxidante o la especie reducida porque gana los electrones.
Combustión del etano
En la reacción de combustión del etano se produce una reacción de oxidación-reducción;
En esta reacción no hay compuestos iónicos, pero igual se puede describir la transferencia de electrones. El carbono C experimenta un cambio en su estado de oxidación de -4 en C2H6 a +4 en CO2:
Por otro lado, el oxígeno cambia de estado de oxidación de 0 en O2 a -2 en el agua y CO2, con una ganancia de dos electrones por átomo:
En esta reacción el agente reductor es el etano y el agente oxidante es el oxígeno O2. El hidrógeno no cambia su estado de oxidación y no participa en el proceso de transferencia de electrones.
Metalurgia
La metalurgia es el proceso de extraer un metal a partir de minerales. En la metalurgia de la galena PbS, un mineral compuesto de plomo y azufre, se realizan varias reacciones de oxidación-reducción para poder extraer el plomo.
En una primera reacción, el sulfuro de plomo reacciona con el oxígeno:
El estado de oxidación para el azufre aumenta de -2 a +4. Así, el azufre se oxida. El estado de oxidación para el oxígeno disminuye de cero a -2, con lo cual se reduce. Entonces el agente oxidante que acepta los electrones es el O2, y el agente reductor que es el que dona electrones es el sulfuro de plomo PbS.
En una segunda reacción, el óxido de plomo reacciona con el monóxido de carbono para producir el metal libre:
El plomo se reduce, su estado de oxidación disminuye de +2 a 0, y el carbono se oxida porque su estado de oxidación aumenta de +2 a +4. El agente oxidante es entonces el PbO y el agente reductor es el CO.
Vea también:
- Reacciones químicas
- Tipos de reacciones químicas
- Ejemplos de reacciones químicas
- Ecuación química.
- Balanceo de ecuaciones químicas
- Reacciones de precipitación: qué son, reglas y ejemplos
Ejercicios de óxido-reducción
1. ¿Cuál es el número de oxidación de los átomos del hexafluoruro de azufre SF6?
2. En la siguiente reacción, ¿cuál es la especie oxidada y cuál la especie reducida?
Referencia
Atkins, P. Jones, L., Laverman, L. (20160 Chemical Principles-The quest for insight. 7th ed. W.H.Freeman. NY.
Rosenberg, J.L., Epstein, L.M., Krieger, P.J. (2007) Schaum's outline of Theory and problems of College Chemistry 9th ed. McGraw-Hill. NY.
Zumdahl, S. S., Zumdahl, S.A. (2014) Chemistry. 9.ª ed. Brooks/Cole